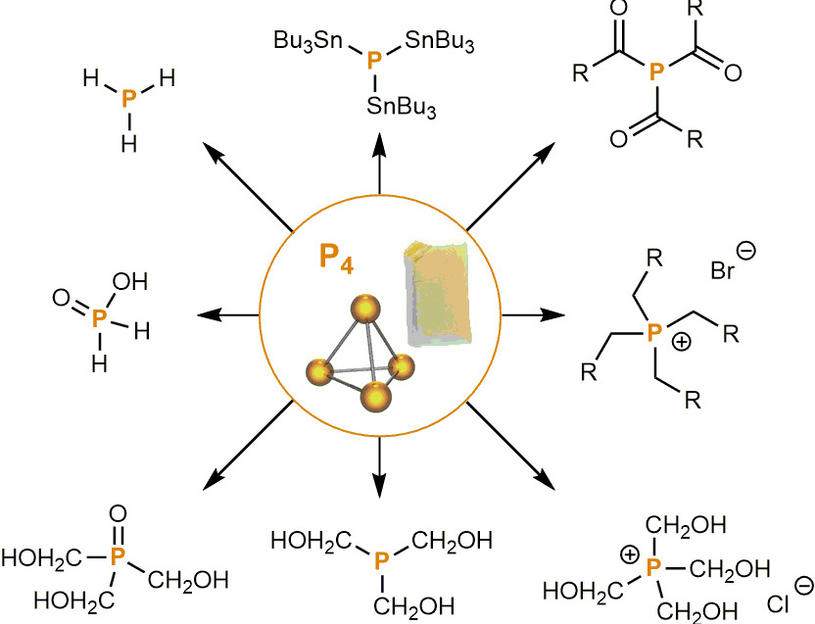
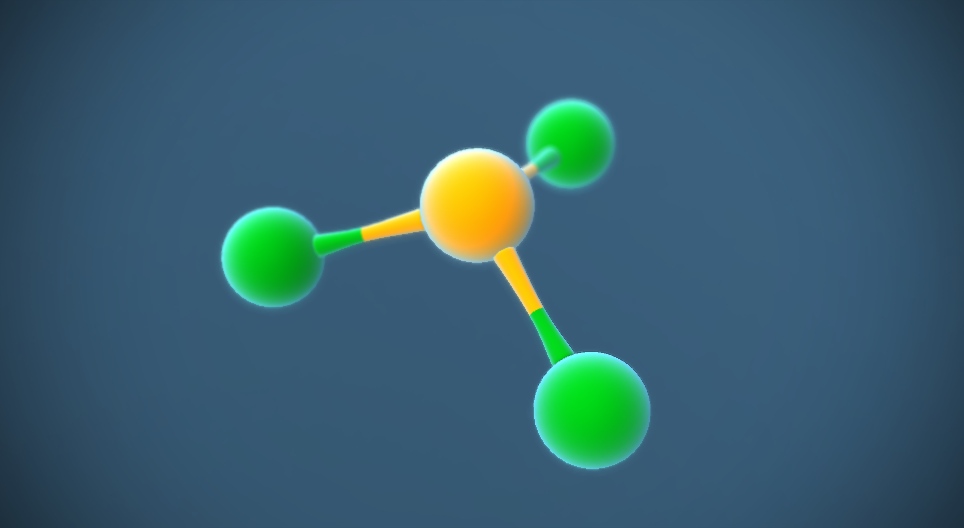
L'hexoxyde de tétraphosphore, ou oxyde de phosphore(III), est l'oxyde de phosphore P4O6. Ce composé a aussi été appelé sesquioxyde de phosphore et trioxyde de diphosphore (ou très souvent, par abus de langage, trioxyde de phosphore) parce qu'il a été longtemps connu sous la formule P2O3 ; il s'est avéré plus tard que la formule brute correcte est P4O6 (dimère).
À l'état solide, ce composé très toxique forme des cristaux blancs d'aspect cireux. C'est l'anhydride de l'acide phosphoreux H3PO3 : il réagit avec l'eau suivant la réaction P4O6 6 H2O → 4 H3PO3 ; en revanche il ne peut pas être obtenu par déshydratation de H3PO3.
Préparation
P4O6 est préparé directement à partir de P4, le phosphore blanc, isolé par Hennig Brandt en 1669.
Aujourd'hui, il est obtenu par oxydation contrôlée puis distillation sous une atmosphère composée à 75 % de O2 et 25 % de N2 à 50 °C et 90 mmHg :
Propriétés chimiques
D'après.
Comportement face à la chaleur
Quand le P4O6 est chauffé autour de 200-400 °C, il se décompose en phosphore rouge et dans une seconde phase qui contient des oxydes de phosphore P4On, avec n pouvant atteindre 10.
Hydrolyse
Comme indiqué dans l'introduction, P4O6 est l'anhydride de l'acide phosphoreux H3PO3 ; son hydrolyse dans l'eau froide donne donc l'acide phosphoreux selon la réaction :
Cela fonctionne aussi en le faisant réagir avec de l'acide chlorhydrique (HClaq) pour donner :
Ligand
P4O6 est aussi un ligand.
Il est entre autres capable de remplacer le monoxyde de carbone du complexe tétracarbonyle de nickel [Ni(CO)4] :
Notes et références
Articles connexes
- Acide phosphorique
- Portail de la chimie